Une nouvelle valve cardiaque en collagène humain, développée par des chercheurs de l’Inserm, révolutionne le traitement des maladies cardiaques pédiatriques telles que la tétralogie de Fallot. Une avancée majeure pour la santé des enfants.
Des chercheurs de l‘Inserm ont mis au point une valve pulmonaire innovante, fabriquée à partir de collagène humain. Cette innovation promet de transformer le traitement des maladies cardiaques pédiatriques telles que la tétralogie de Fallot. Cette percée a été réalisée au sein du laboratoire de Bioingénierie tissulaire BioTis (Inserm/Université de Bordeaux) à Bordeaux, qui se spécialise dans le développement de tissus biologiques dérivés de cellules humaines. Les résultats de cette étude ont été publiés dans la revue Science Translational Medicine.
La tétralogie de Fallot : un défi médical
La tétralogie de Fallot est une malformation cardiaque congénitale touchant une naissance sur 4 000. Cette pathologie cardiaque se caractérise par une sténose pulmonaire, un rétrécissement de la voie de sortie du sang du ventricule droit du cœur vers l’artère pulmonaire. Cette obstruction de la valve limite l’écoulement sanguin vers les poumons, réduisant ainsi le taux d’oxygène dans le sang des enfants atteints par la maladie.
Les limites des traitements actuels
La correction de cette anomalie nécessite une chirurgie pour élargir la voie pulmonaire, impliquant la reconstruction de la valve pulmonaire. Les solutions actuelles utilisent des membranes synthétiques en Téflon™ ou des feuillets biologiques issus de tissu animal traité chimiquement. Cependant, ces options posent des problèmes, notamment des réactions immunitaires et inflammatoires chroniques, des risques de thromboses et de calcification, ainsi que des infections bactériennes. De plus, ces valves ne s’adaptent pas à la croissance des enfants, nécessitant ainsi des opérations répétées.
Une solution biologique prometteuse
L’équipe dirigée par Fabien Kawecki a développé une valve pulmonaire de nouvelle génération, constituée de feuillets riches en collagène produits par des cellules humaines. Le collagène, une protéine structurale abondante dans le corps humain, est cultivé en laboratoire pour créer des dépôts de matrice extracellulaire. Ces feuillets, utilisés pour fabriquer des valves pulmonaires, ne sont pas perçus comme des corps étrangers par le système immunitaire, évitant ainsi les complications liées au rejet.
Comment le collagène humain est utilisé pour créer la valve
Les chercheurs commencent par prélever des cellules humaines, souvent des fibroblastes, qui produisent du collagène humain naturellement. Ces cellules peuvent être obtenues à partir de biopsies cutanées ou d’autres sources de tissus humains. Ensuite, les cellules sont cultivées en laboratoire dans des conditions strictement contrôlées pour les amener à se multiplier et à produire du collagène en abondance. Les milieux de culture utilisés sont spécialement formulés pour favoriser la croissance cellulaire et la production de collagène.
Une fois que les cellules ont produit suffisamment de collagène, ce dernier est extrait sous forme de dépôts de matrice extracellulaire. Ces dépôts sont transformés en feuillets de collagène, qui servent de matière première pour fabriquer la valve. Les feuillets de collagène sont assemblés pour former une structure qui imite la valve pulmonaire humaine.
Des tests concluants
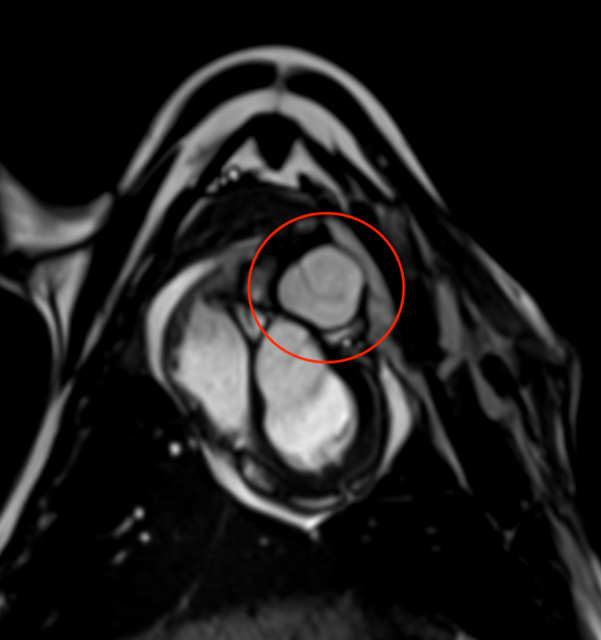
Les chercheurs ont testé cette valve dans un modèle de cœur « organo-synthétique » développé avec le MIT, reproduisant le fonctionnement du cœur humain. Ils ont également implanté la valve dans un modèle animal (ovin) avec succès. Fabien Kawecki précise :
« Grâce à nos deux modèles, nous avons obtenu une preuve de concept que la valve que nous avons conçue est fonctionnelle et peut facilement être implantée en suivant les mêmes modalités chirurgicales que chez l’humain. L’implantation de notre valve a permis de rétablir le sens de circulation du sang à travers la voie pulmonaire sans générer de fuite valvulaire. Nous avons aussi observé qu’après seulement 7 jours d’implantation, il y avait une bonne intégration de la valve avec le tissu natif de l’animal. De plus, nous avons vu sur notre valve la présence de cellules musculaires lisses qui joueront un rôle important dans son remodelage et sa croissance. »
Vers des applications cliniques
Les données recueillies ont permis de développer un modèle numérique pour tester la fonctionnalité et l’utilité clinique de différents biomatériaux. Ce modèle, ainsi que celui du cœur organo-synthétique, seront des outils précieux pour les chercheurs et chirurgiens pour tester de nouveaux biomatériaux et dispositifs médicaux, ainsi que pour s’entraîner à de nouvelles techniques chirurgicales.
L’équipe prévoit d’implanter la valve sur des périodes plus longues (16 semaines, puis un an) pour garantir sa fonctionnalité à long terme et son adaptation à la croissance de l’animal. Si les résultats sont positifs, des essais cliniques pourront être envisagés. Un brevet a déjà été déposé pour l’utilisation de ce biomatériau en tant que valve pulmonaire, avec l’espoir de l’appliquer à diverses maladies cardiovasculaires chez l’adulte et l’enfant.
Cette innovation marque un pas important vers des traitements plus efficaces et durables pour les jeunes patients atteints de maladies cardiaques.
Sources :
Hemodynamic evaluation of biomaterial-based surgery for Tetralogy of Fallot using a biorobotic heart, in silico, and ovine models
1 Institute for Medical Engineering and Science, Massachusetts Institute of Technology, Cambridge, MA, USA 02142.
2 IHU Liryc, Electrophysiology and Heart Modeling Institute, F-33604 Pessac, France.
3 Congenital Heart Diseases Department, CHU de Bordeaux, F-33604 Pessac, France.
4 Univ. Bordeaux, INSERM, BioTis, U1026, F-33000 Bordeaux, France.
5 Department of Adult Intensive Care Medicine, Lausanne University Hospital and University of Lausanne, Switzerland CH-1011.
6 Department of Mechanical Engineering, Massachusetts Institute of Technology, Cambridge, MA, USA 02139.
7 Department of Surgery, Beth Israel Deaconess Medical Center, Boston, MA, USA 02215.
8 Plateforme d’histopathologie, TBMcore INSERM US005 – CNRS 3427, F-33000 Bordeaux, France.
Science Translational Medicine, juillet 2024
DOI : 10.1126/scitranslmed.adk2936