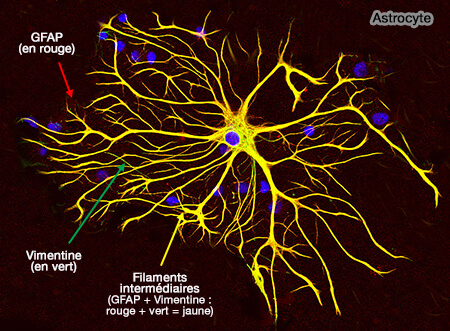
Les astrocytes sont des cellules du cerveau qui ont longtemps été considérées uniquement comme de simples cellules de soutien des neurones. Depuis quelques années, elles sont de plus en plus étudiées, et leur importance pour le fonctionnement du cerveau est peu à peu mis au jour. Des chercheurs de l’Inserm, du CNRS et du Collège de France au Centre interdisciplinaire de recherche en biologie révèlent désormais le rôle crucial de ces cellules dans la fermeture de la période de plasticité cérébrale qui suit la naissance. Les astrocytes auraient une place centrale dans le développement des facultés sensorielles et cognitives après la naissance.
La plasticité cérébrale est une période transitoire clé où le cerveau, après la naissance, remodèle le câblage des neurones en fonctions des stimulations extérieures qu’il reçoit (environnement, interactions…). La fin – ou fermeture – de cette période marque la stabilisation des circuits neuronaux, associé à un traitement efficace des informations et à un développement cognitif normal. Cela ne signifie pas qu’il n’y a plus aucune plasticité ensuite, mais qu’elle est très réduite par rapport au début de la vie.
Les problèmes qui interviennent pendant la période de plasticité cérébrale peuvent avoir des conséquences importantes à long terme. Ainsi par exemple, si durant cette période un individu souffre d’une pathologie oculaire qui l’empêche de voir correctement, comme par exemple un strabisme, le câblage cérébral qui correspond à cette faculté sera altéré définitivement si l’œil n’est pas soigné à temps.
Afin d’y remédier, les chercheurs ont pour objectif de remodeler ce câblage en identifiant une thérapie qui permettrait de réintroduire la plasticité cérébrale même après la fin du développement. Pour cela, ils cherchent aussi à mieux caractériser les mécanismes biologiques qui sous-tendent la fermeture de la période de plasticité cérébrale.
Des études pionnières des années 1980 ont montré que greffer des astrocytes immatures dans le cerveau d’animaux adultes permettait d’induire à nouveau une période de grande plasticité. L’équipe de la chercheuse Inserm Nathalie Rouach au Centre interdisciplinaire de recherche en biologie (Inserm/CNRS/Collège de France)[1] s’est inspirée de ce procédé pour révéler le processus cellulaire, jusqu’ici inconnu, à l’origine de la fermeture de la période de plasticité.
La greffe d’astrocytes immatures pour réintroduire la plasticité cérébrale
A travers des expériences menées en s’intéressant au cortex visuel de la souris, les chercheurs montrent que la présence des astrocytes immatures est clé pour la plasticité cérébrale. Les astrocytes orchestrent ensuite plus tard dans le développement la maturation d’interneurones[2] pendant la période de plasticité, ce qui aboutit in fine à sa fermeture. Ce processus de maturation a lieu via un mécanisme inédit impliquant l’action de la Connexine 30, une protéine que les chercheurs ont retrouvée en forte concentration dans les astrocytes matures durant la période de fermeture.
Le fait de greffer des astrocytes à des souris adultes pourrait-il permettre réintroduire une plasticité cérébrale ?
Afin de répondre à cette question, les chercheurs ont mis en culture des astrocytes immatures issues du cortex visuel de jeunes souris (qui avaient entre 1 et 3 jours). Ils ont ensuite greffé ces astrocytes immatures dans le cortex visuel primaire de souris adultes. Il s’agissait alors d’évaluer l’activité du cortex visuel après quatre jours d’occlusion monoculaire, une technique classique pour évaluer la plasticité cérébrale. Les chercheurs ont alors trouvé que la souris greffée avec des astrocytes immatures présentait un haut niveau de plasticité, contrairement à la souris non greffée.
« Cette étude nous rappelle qu’en neurosciences nous ne devons pas uniquement nous intéresser aux neurones. Les cellules gliales, dont les astrocytes font partie, régulent la plupart des fonctions du cerveau. Nous avons réalisé que ces cellules ont des rôles actifs. Les cellules gliales sont en effet moins fragiles que les neurones et constituent donc un moyen plus accessible d’intervenir sur le cerveau. », souligne Nathalie Rouach, coordinatrice de l’étude.
Ces travaux sur les astrocytes permettent d’envisager de nouvelles stratégies cellulaires et moléculaires visant à ré-ouvrir une période de plasticité accrue chez l’adulte afin par exemple de favoriser la réadaptation après une lésion cérébrale ou de pallier les dysfonctionnements sensori-moteurs ou psychiatriques issus de troubles neuro-développementaux.
[1] UMR CNRS ayant participé : Institut des Neurosciences Paris-Saclay) et Laboratoire des maladies neurodégénératives : mécanismes, thérapies, imageries (CNRS/CEA/Université Paris Saclay)
[2] Les interneurones établissent des connexions entre un réseau de neurones afférent (qui envoie les informations au système nerveux central) et un réseau de neurones efférents (qui envoient ces informations vers les organes répondant à la stimulation).
Sources :
Astrocytes close the mouse critical period for visual plasticity
Jérôme Ribot1‡, Rachel Breton1,2,3‡#, Charles-Félix Calvo1 , Julien Moulard1,4 3 , Pascal Ezan1 , Jonathan Zapata1 , Kevin Samama1 , Matthieu Moreau5 , Alexis-Pierre Bemelmans6 4 , Valentin Sabatet7 , Florent Dingli7 , Damarys Loew7 , Chantal Milleret1 , Pierre Billuart5 , Glenn Dallérac1£#, Nathalie Rouach1£
1 Center for Interdisciplinary Research in Biology, Collège de France, CNRS UMR 7241, INSERM U1050, Labex Memolife, PSL Research University Paris, France
2 Doctoral School N°568, Paris Saclay University, PSL Research University, Le Kremlin Bicetre, France
3 Astrocytes & Cognition, Paris-Saclay Institute for Neurosciences, CNRS UMR 9197, Paris Saclay University, Orsay, France
4 Doctoral School N°158, Sorbonne University, Paris France
5 Université de Paris, Institute of Psychiatry and Neuroscience of Paris (IPNP), INSERM U1266, Genetic and Development of Cerebral Cortex Laboratory, GHU Paris Psychiatrie et Neurosciences, Hôpital Saint Anne, Paris, France
6 Commissariat à l’Energie Atomique et aux Energies Alternatives (CEA), Département de la Recherche Fondamentale, Institut de biologie François Jacob, MIRCen, and CNRS UMR 9199, Université Paris-Saclay, Neurodegenerative Diseases Laboratory, Fontenay-aux-Roses, France
7 Institut Curie, PSL Research University, Mass Spectrometry and Proteomics Laboratory, Paris, France
‡ Equal contributing authors
£ Equal contributing authors
Science, 1er Juillet 2021
DOI : 10.1126/science.abf5273