Voici les découvertes scientifiques autour de la sénescence cellulaire et de l’enzyme Glycerol Kinase ouvrant la porte a des traitements anti-âge révolutionnaires.
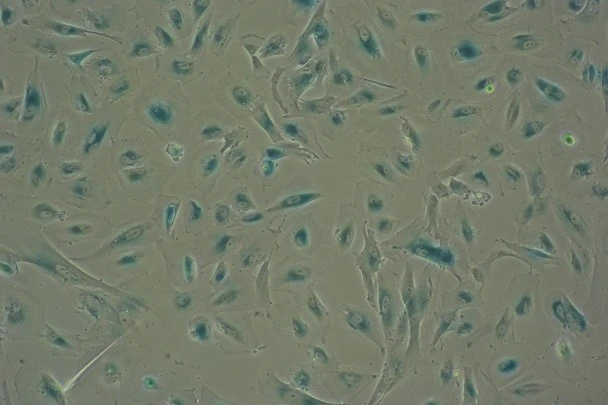
La sénescence cellulaire, un arrêt naturel de la division cellulaire, joue un rôle crucial dans l’apparition des maladies liées à l’âge. Une étude significative publiée dans Nature Metabolism par des chercheurs de renom de l’Inserm, de l’université Paris Cité, et du CNRS au sein de l’Institut Necker Enfants Malades, mettent en lumière le potentiel de l’enzyme Glycerol Kinase (GK). L’activation de cette enzyme entraine l’arrêt de la prolifération cellulaire et lance un processus de sénescence, identifiable par une coloration bleue des cellules, indicateur de ce phénomène biologique. De fait, des traitements anti-âge révolutionnaires vont pouvant être mis en place.
Décryptage des changements métaboliques : une nouvelle cible dans la lutte contre les maladies du vieillissement
L’étude avance dans la compréhension des processus biologiques de la sénescence, en mettant en évidence que les modifications métaboliques, en particulier l’accumulation de lipides dans les cellules, pourraient être exploitées pour concevoir des thérapies innovantes contre les maladies liées à l’âge. En utilisant des approches de transcriptomique et de métabolomique pour analyser les cellules sénescentes soumises à divers stress (ADN endommagé, conversion d’une cellule normale en cellule cancéreuse,…) , les chercheurs ont pu définir une signature métabolique spécifique à la sénescence. Cette signature inclut l’accumulation de métabolites clés tels que le lactate, l’alpha ketoglutarate, le glycérol-3-phosphate (G3P), et la phosphoéthanolamine (PEtn), résultant de l’altération de l’activité de certaines enzymes, y compris la glycérol kinase. Ces découvertes, confirmées dans d’autres contextes cellulaires et chez des modèles animaux, suggèrent des pistes prometteuses pour le développement de stratégies thérapeutiques ciblant spécifiquement la sénescence cellulaire avec à la clé des traitements anti-âge révolutionnaires.
« En combinaison avec d’autres mesures, cette signature métabolique pourra être utilisée comme biomarqueur du vieillissement cellulaire et ainsi permettre son suivi pendant la vie d’un individu », explique Mario Pende.
Perspectives futures de la recherche sur la sénescence
La sénescence cellulaire représente un domaine de recherche fondamental pour la médecine anti-âge. Les résultats de cette étude ouvrent non seulement de nouvelles voies pour la compréhension des maladies liées à l’âge mais proposent également des cibles thérapeutiques basées sur les changements métaboliques des cellules sénescentes. La manipulation de l’enzyme Glycerol Kinase et d’autres facteurs métaboliques identifiés pourrait conduire à la conception de traitements novateurs visant à réduire l’impact du vieillissement sur la santé. En poursuivant les recherches dans cette direction, les scientifiques espèrent élaborer des stratégies efficaces pour retarder ou inverser les effets du vieillissement cellulaire, offrant ainsi une meilleure qualité de vie aux populations vieillissantes.
« Nous ne sommes pas parvenus à redémarrer le cycle cellulaire et à pousser les cellules sénescentes à se multiplier à nouveau. En revanche, nous avons pu observer clairement une diminution des marqueurs inflammatoires associés au processus de sénescence. Nos résultats indiquent donc globalement que réguler le changement métabolique observé dans les cellules sénescentes pourrait être une stratégie prometteuse pour cibler la sénescence cellulaire dans les maladies liées au vieillissement », conclut Mario Pende.
Sources :
A homoeostatic switch causing glycerol-3-phosphate and phosphoethanolamine accumulation triggers senescence by rewiring lipid metabolism
Khaled Tighanimine1, José Américo Nabuco Leva Ferreira Freitas 2,3,4,16, Ivan Nemazanyy 5,16, Alexia Bankolé 1, Delphine Benarroch-Popivker6, Susanne Brodesser 7, Gregory Doré 8, Lucas Robinson 9,10, Paule Benit 11, Sophia Ladraa 1, Yara Bou Saada 12, Bertrand Friguet 12, Philippe Bertolino 13, David Bernard 13, Guillaume Canaud 1,14, Pierre Rustin 11, Eric Gilson 6,15, Oliver Bischof 2 , Stefano Fumagalli 1 & Mario Pende 1
1 Institut Necker Enfants Malades (INEM), Universite Paris Cite, CNRS, Inserm, Paris, France.
2 IMRB, Mondor Institute for Biomedical Research, Inserm U955, Universite Paris Est Creteil, UPEC, Faculte de Medecine de Creteil 8, Creteil, France.
3 Biological Adaptation and Ageing B2A (IBPS), Sorbonne Universite, UMR 8256, Paris, France.
4 Inserm U1164, Paris, France.
5 Platform for Metabolic Analyses, Structure Federative de Recherche Necker, Inserm US24/CNRS, UAR, Paris, France.
6 Institute for Research on Cancer and Aging (IRCAN), Universite Cote d’Azur, Inserm, CNRS, Nice, France.
7 Cluster of Excellence Cellular
Stress Responses in Aging-associated Diseases (CECAD) at the University of Cologne, Faculty of Medicine, University Hospital of Cologne, Cologne, Germany.
8 Plasmodium RNA Biology Unit, Institut Pasteur, Paris, France.
9 Department of Cell Biology and Infection, Institut Pasteur, Paris, France.
10 Inserm, U993, Paris, France.
11 Neurodiderot, Universite Paris Cite, Inserm U1141, Paris, France.
12 Biological Adaptation and Ageing (B2A-IBPS), Sorbonne Universite, CNRS, Inserm, Institut de Biologie Paris Seine, Paris, France.
13 Equipe Labellisee la Ligue Contre le Cancer, Centre de Recherche en Cancerologie de Lyon, Inserm U1052, CNRS UMR 5286, Centre Leon Berard, Universite de Lyon, Lyon, France.
14 Unite de Medecine Translationnelle et Therapies Ciblees, Hopital Necker-Enfants Malades, AP-HP, Paris, France.
15 Department of Medical Genetics, University Hospital (CHU) of Nice, Nice, France.
16 These authors contributed equally: Jose Americo Nabuco Leva Ferreira Freitas, Ivan Nemazanyy.
Nature Metabolism, février 2024
DOI:10.1038/S42255-023-00972-Y