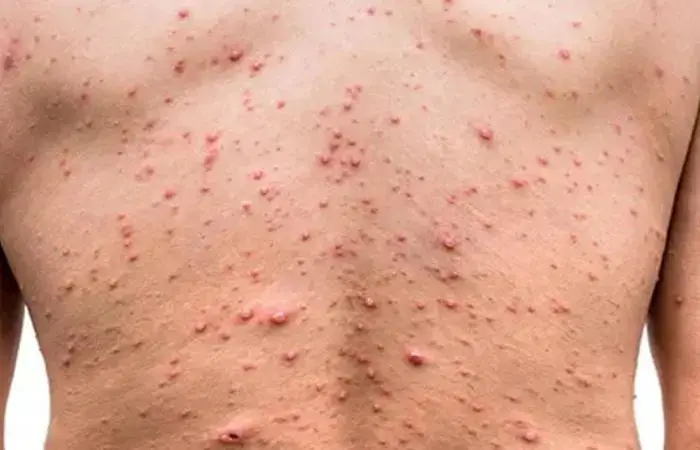
En 2022-2023, il y a eu une augmentation significative de cas de variole du singe, causée par le virus Monkeypox, maintenant appelé virus mpox (MPXV), qui a touché un large public. Cette épidémie a été responsable de 87 000 cas humains répartis dans 170 pays1, la plupart en dehors des régions où le virus était habituellement présent. Qu’est-ce que cette maladie ? Comment se transmet-t-elle ? Est-elle dangereuse ? Où en est la recherche ? On vous explique tout.
(Mise à jour le 06 juin 2023 )
En 2022-2023, une épidémie sans précédent de 87 000 cas de variole du singe est apparue dans des zones non endémiques ; elle a touché ainsi des personnes sans lien direct avec un voyage en Afrique du Centre ou de l’Ouest où le virus est présent historiquement. Le virus MPXV est transmis essentiellement par des rongeurs à l’homme, puis la transmission interhumaine se fait par des gouttelettes respiratoires ou contact rapproché. Les symptômes sont atténués par rapport à ceux de la variole humaine, et la létalité est plus faible. Selon Santé publique France, environ 5 000 cas d’infection à MPXV ont été recensés en France depuis mai 20222. Le MPXV circule toujours, à très bas bruit dans les zones non endémiques, c’est pourquoi il est important de mieux le caractériser et d’analyser la réponse immunitaire des personnes infectées par le virus ou vaccinées par IMVANEX, le vaccin actuellement disponible, de troisième génération, développé initialement contre la variole humaine.
Pour mieux comprendre les mécanismes impliqués dans la variole du singe et définir des moyens de protection contre l’infection et la gravité de la maladie, des scientifiques et des cliniciens de renom, issus de l’Institut Pasteur, du CNRS, de l’Inserm, du VRI et de l’AP-HP, ont mené une étude approfondie. Ils ont examiné 470 échantillons de sérum provenant de personnes vaccinées ou infectées par le virus MPXV. Les chercheurs ont évalué la sensibilité de ce virus aux anticorps neutralisants et analysé la réponse immunitaire des individus infectés ou vaccinés. Au cours de cette étude, ils ont découvert le rôle clé du complément, qui est un composant important du système immunitaire.
Cette recherche a fourni des informations cruciales sur les mécanismes de défense contre le virus mpox. Les résultats ont montré comment les anticorps neutralisants peuvent combattre efficacement le virus et protéger contre l’infection. De plus, l’analyse de la réponse immunitaire des individus infectés ou vaccinés a permis d’identifier des corrélats de protection, c’est-à-dire des marqueurs spécifiques qui indiquent le niveau de protection contre l’infection ou la gravité de la maladie.
Ces découvertes ont des implications importantes pour le développement de stratégies de prévention et de traitement contre la variole du singe. Elles fournissent une base solide pour la mise au point de vaccins plus efficaces et le développement de thérapies ciblées. Grâce aux efforts de ces chercheurs et cliniciens, nous sommes mieux armés pour faire face à cette maladie et protéger la santé publique.
Qu’est-ce que la variole du singe ?
La variole du singe est une maladie rare, cousine de la variole qui entraine bon nombre d’épidémie en Afrique, sans que l’on en parle. Elle a été découverte à Copenhague (Danemark) sur des singes vivant dans une animalerie, en 1958 qui présentaient des lésions cutanées qui ressemblait à la variole. D’où son nom : la variole du singe. Mais ce virus est bien plus présents chez les écureuils et les rongeurs.
Le premier cas a été détecté en Afrique Centrale sur un enfant en 1970.
Quels sont les symptômes de la variole du singe ?
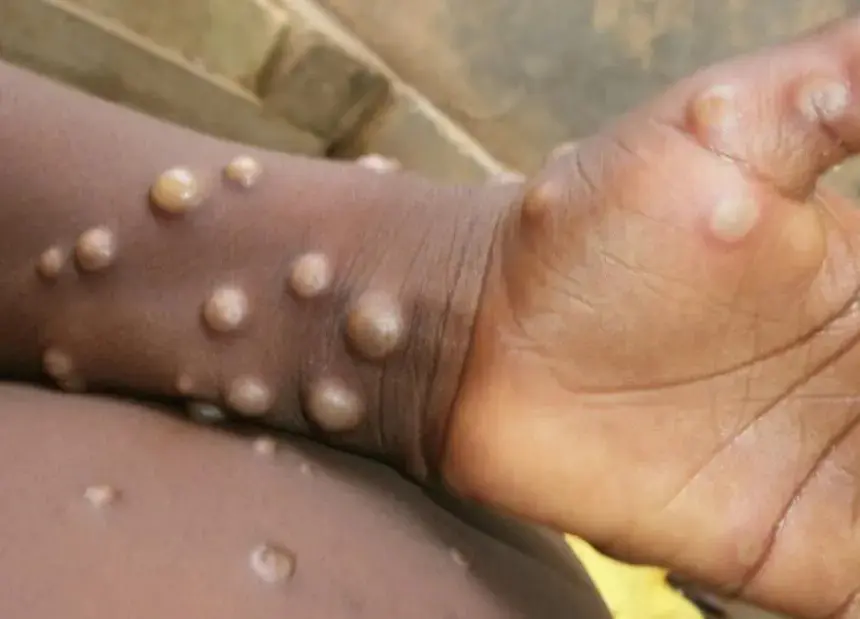 La variole du singe entraine l’apparition de lésions au niveau de la peau formant ensuite des croûtes qui ressemble à la varicelle. La maladie peut aussi être accompagnée, dans les premiers jours de l’infection :
La variole du singe entraine l’apparition de lésions au niveau de la peau formant ensuite des croûtes qui ressemble à la varicelle. La maladie peut aussi être accompagnée, dans les premiers jours de l’infection :
- de maux de tête,
- de fatigue,
- de la fièvre,
- de douleurs musculaires.
Est-elle dangereuse et quels sont les traitements ?
En principe, la maladie est bénigne et cesse au bout d’une vingtaine de jours, sans aucun traitement.
Même si elle est la plupart du temps sans danger, il y a des formes graves et des décès (la létalité oscille entre 1 à 10%) surtout chez les enfants, les personnes âgées ou les personnes présentant des comorbidités.
D’après les dernières petites études, il semblerait que le vaccin classique contre la variole serai efficace à 85% et empêcherai les formes graves (vaccin qui n’est plus prescrit automatiquement en France depuis 1978).
Comment se transmet-elle ?
La variole du singe est, au départ une zoonose c’est à dire une maladie infectieuse transmise des animaux à l’homme. Rappelons que ce sont des rongeurs et des écureuils qui sont porteurs de la maladie.
L’Organisation Mondiale de la Santé (OMS) nous apprend qu’elle se transmet essentiellement avec les gouttelettes respiratoires mais en restant longtemps en présence de la personne contaminée. D’où sa faible contagiosité contrairement au Covid où les gouttelettes se propagent dans l’air.
Cependant, comme la variole du singe entraine des éruptions cutanées remplies de liquide infecté, si vous touchez un objet qu’une personne contaminée aura touché avant vous, un bouton d’ascenseur ou une poignée de porte, par exemple, vous risquez d’être également contaminé. Et bien entendu, le « peau à peau » est vecteur de contamination.
D’après les nouvelles observations des médecins africains, il semblerait que la variole du singe soit une IST (infection sexuellement transmissible) touchant beaucoup les homosexuels hommes mais aussi les hétérosexuels.
Notons, enfin, que cette maladie a été très peu étudiée car découverte dans des endroits perdus au Congo ou au fin fond de l’Afrique Centrale et les autorités sanitaires mondiales la connaissent encore très mal.
Comment se protéger de la maladie ?
Les autorités sanitaires mondiale préconisent d’isoler les personnes contaminées afin de bien circonscrire la maladie et évitez une éventuelle pandémie.
Pour éviter d’être contaminé :
- Lavez-vous régulièrement les mains,
- Ne touchez pas une personne malade,
- Ne restez pas longtemps en présence de quelqu’un ayant attrapé le virus,
- Ayez des rapports sexuels protégés.
Au vue de la multiplication des cas, l’Espagne a commandé de milliers de vaccins contre la variole ‘normale’.
La Haute autorité de santé (HAS) préconise la mise en place d’une « stratégie vaccinale réactive ». Celle-ci a pour but de ne vacciner que les cas contacts à risque.
La recherche avance
Les équipes de recherche ont collaboré avec des cliniciens, des vaccinologues et des virologues de trois hôpitaux français (Hôpital Henri Mondor de Créteil, Hôpital de la Pitié- Salpêtrière et Hôpital d’Orléans) pour réaliser ces travaux multidisciplinaires. Le grand nombre de sérums analysés a permis d’obtenir une puissance statistique, et d’affiner l’analyse sur des sous-groupes de patients selon différents critères comme celui de l’âge par exemple.
Dans cette étude, publiée dans la revue Cell Host & Microbe, revue de référence sur les interactions entre microbes et système immunitaire, les scientifiques ont étudié la sensibilité du MPXV aux anticorps neutralisants (NAbs) générés après une infection par le virus et/ou une vaccination par IMVANEX. En effet, le vaccin IMVANEX a été utilisé comme prophylaxie pré et post-exposition dans les populations à haut risque, mais son efficacité reste mal caractérisée. Pour étudier cette sensibilité du virus, l’équipe de scientifiques a développé deux tests cellulaires pour la quantification des anticorps neutralisants en utilisant soit le virus atténué utilisé comme vaccin (MVA), soit une souche MPXV isolée chez un individu récemment infecté.
Cette étude a permis de mettre en évidence le rôle du complément4, déjà connu pour d’autres poxvirus, et de décrire l’activité neutralisante des anticorps générés par l’infection ou la vaccination. Des niveaux robustes d’anticorps anti-MVA ont été détectés après une infection, une vaccination antivariolique historique, l’administration d’IMVANEX ou d’un autre vaccin candidat à base de MVA. MPXV est peu sensible à la neutralisation en l’absence de complément. L’ajout de complément issu de sérums améliore la détection par les individus qui ont des anticorps et augmente leur taux d’anticorps anti-MPXV. Quatre semaines après l’infection, des NAb anti-MVA et -MPXV ont été observés chez 94 % et 82 % des individus, respectivement. Deux doses d’IMVANEX ont généré des NAb anti-MVA et -MPXV détectables chez 92 % et 56 % des receveurs du vaccin, respectivement.
Les personnes nées avant 1980 sont mieux protégées contre la variole du singe
Le plus haut taux d’anticorps a été retrouvé chez les individus nés avant 1980 (donc vaccinés contre la variole) que ce soit après infection ou après administration d’IMVANEX, soulignant l’impact de la vaccination antivariolique historique sur les réponses immunitaires à l’infection ou à l’administration d’IMVANEX. Cela suggère qu’une sorte d’immunité hybride a été générée chez les individus infectés qui ont été vaccinés dans leur enfance.
Depuis l’arrêt de la vaccination massive contre la variole dans les années 1980, le nombre d’infections au virus mpox (MPXV) ne cesse de croître. Cette situation préoccupante a incité des chercheurs à développer des tests de neutralisation sensibles, dans le cadre d’une étude importante. Ces tests peuvent jouer un rôle essentiel en identifiant des marqueurs de protection contre l’infection ou la gravité de la maladie. De plus, ils peuvent être utilisés pour mener des enquêtes épidémiologiques, évaluer la durée de protection conférée par une infection antérieure ou par des vaccins existants et en développement, ainsi que pour analyser l’efficacité de thérapies immunologiques.
Le responsable de l’unité Virus et immunité à l’Institut Pasteur, Olivier Schwartz, qui est le principal auteur de cette étude, souligne l’importance de ces tests. Selon lui, ils représentent des outils précieux pour mieux comprendre les mécanismes de propagation du virus mpox, ses conséquences sur la santé publique, et pour améliorer la prise en charge des patients.
Grâce à ces tests de neutralisation, les chercheurs pourront développer une meilleure compréhension de la manière dont le virus mpox se propage et comment il affecte notre santé. Ces informations seront essentielles pour optimiser les stratégies de prévention et de traitement de cette maladie. L’étude menée par les chercheurs de l’Institut Pasteur constitue une avancée majeure dans la lutte contre la variole du singe et renforce notre capacité à faire face à cette menace pour la santé publique.
Sources :
Complement-dependent mpox virus-neutralizing antibodies in infected and vaccinated individuals, Cell Host & Microbe, 4 mai 2023
Mathieu Hubert1, Florence Guivel-Benhassine1, Timothée Bruel1, Françoise Porrot1, Delphine Planas1, Jessica Vanhomwegen2, Aurélie Wiedemann3, Sonia Burrel4, Stéphane Marot5, Romain Palich6, Gentiane Monsel6, Harouna Diombera3, Sébastien Gallien7, Jose Luis Lopez- Zaragoza7, William Vindrios7, Fabien Taieb8, Sandrine Fernandes-Pellerin9, Maurine Delhaye9, Hélène Laude9, Laurence Arowas9, Marie-Noelle Ungeheuer9, Laurent Hocqueloux10, Valérie Pourcher6, Thierry Prazuck10, Anne-Geneviève Marcelin5, Jean-Daniel Lelièvre3,7, Christophe Batéjat2, Yves Lévy3,7, Jean-Claude Manuguerra2, Olivier Schwartz1,11,*
1 Institut Pasteur, Université Paris Cité, Virus and Immunity Unit, CNRS UMR3569, 75015 Paris, France, & Vaccine Research Institute, 94000 Créteil, France.
2 Institut Pasteur, Université Paris Cité, Unité Environnement et Risques Infectieux, Cellule d’Intervention Biologique d’Urgence (CIBU), 75015 Paris, France
3 Vaccine Research Institute, Université Paris-Est Créteil, Faculté de Médecine, INSERM U955, Team 16, 94000 Créteil, France
4 Université de Bordeaux, CNRS UMR 5234, Fundamental Microbiology and Pathogenicity, Hôpital Universitaire de Bordeaux, Service de Virologie, 33000 Bordeaux, France
5 Sorbonne Université, INSERM, Institut Pierre Louis d’Epidémiologie et de Santé Publique, AP- HP, Hôpitaux Universitaires Pitié-Salpêtrière – Charles Foix, Laboratoire de Virologie, 75013 Paris, France
6 Sorbonne Université, INSERM 1136, Institut Pierre Louis d’Epidémiologie et de Santé Publique, Assistance Publique – Hôpitaux de Paris, Hôpitaux Universitaires Pitié-Salpêtrière Charles Foix, Service de Maladies infectieuses et Tropicales, 75013 Paris, France 7Assistance Publique-Hôpitaux de Paris, Groupe Henri-Mondor Albert-Chenevier, Service Immunologie Clinique, 94000 Créteil, France
8 Medical Center of Institut Pasteur, 75015 Paris, France
9 ICAReB-Clin platform, Institut Pasteur, 75015 Paris, France
10 CHR Orléans, Service de Maladies Infectieuses, 45100 Orléans, France
11 Lead contact
* Corresponding author
Sophie Madoun