Les émulsifiants sont des additifs alimentaires utilisés pour améliorer la texture et prolonger la durée de conservation des aliments. On les retrouve dans de nombreux plats transformés (crèmes glacées, gâteaux emballés, sauces…), bien que leurs effets néfastes sur l’équilibre intestinal aient été démontrés. Des scientifiques ont aspiré à contrecarrer les effets délétères induits par la consommation d’émulsifiants en fortifiant l’épithélium intestinal via son repeuplement par une bactérie naturellement présente dans l’intestin : Akkermansia muciniphila. Ajouter cette bactérie au microbiote intestinal permettrait d’empêcher les dommages causés par la consommation d’agents émulsifiants. De fait, protéger son microbiote des additifs alimentaires grâce à une bactérie est possible.
Des millions de personnes consomment des agents émulsifiants quotidiennement. Ces produits figurent parmi la liste des additifs alimentaires les plus largement utilisés par l’industrie agroalimentaire. Et pour cause, ils permettent d’améliorer la texture des aliments et de prolonger leur durée de conservation. Par exemple, des émulsifiants comme la lécithine et les polysorbates garantissent la texture onctueuse des crèmes glacées industrielles et évitent qu’elles ne fondent trop rapidement une fois servies. Mais comment protéger son microbiote des additifs ?
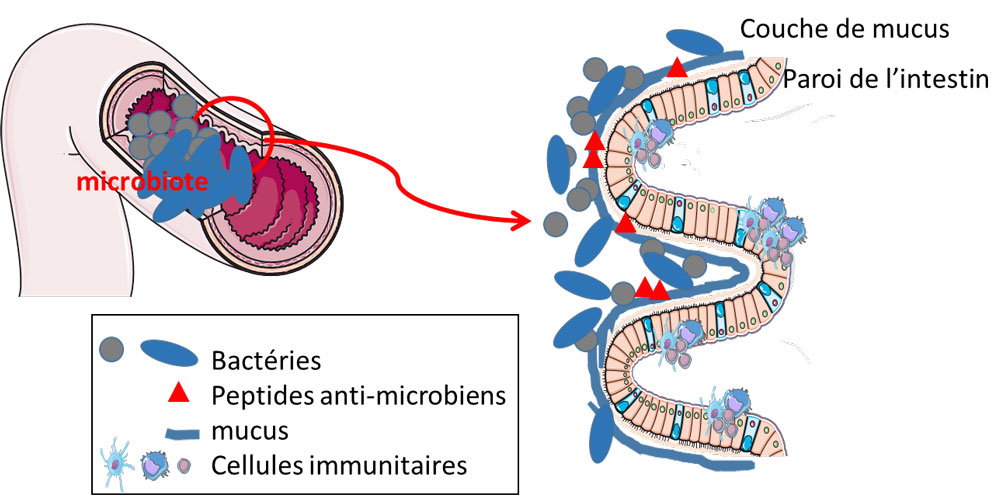
De précédents travaux menés par l’équipe de Benoît Chassaing, chercheur Inserm à l’Institut Cochin (Inserm/CNRS/Université Paris Cité), ont montré que la consommation de certains agents émulsifiants entraînait l’altération du microbiote intestinal[1] et son interaction avec l’appareil digestif. Ces altérations du microbiote conduisent à une inflammation intestinale chronique et à des dérégulations métaboliques. Plus précisément, ces recherches ont montré que la consommation d’émulsifiants alimentaires induisait la capacité de certains éléments du microbiote à rentrer en contact étroit avec l’épithélium – la première ligne de défense de l’appareil digestif qui normalement est stérile.
Protéger son microbiote des additifs grâce à une bactérie
Dans cette nouvelle étude, les chercheurs ont voulu contrecarrer les effets délétères induits par la consommation d’émulsifiants en fortifiant l’épithélium intestinal. Pour cela, ils se sont intéressés plus spécifiquement à la bactérie Akkermansia muciniphila, qui, naturellement présente dans l’intestin, a déjà révélé avoir un impact sur les interactions du microbiote avec le reste de l’organisme. Par ailleurs, on sait que la quantité de cette bactérie se retrouve diminuée suite à la consommation d’agents émulsifiants.
Des groupes de souris ont ainsi reçu des agents émulsifiants par le biais de leur alimentation, supplémentée ou non avec une dose quotidienne d’Akkermansia muciniphila. Les scientifiques ont observé que, tandis que la consommation d’agents émulsifiants alimentaires était suffisante pour induire une inflammation chronique associée à des altérations du métabolisme et à une hyperglycémie, les souris recevant Akkermansia muciniphila étaient totalement protégées contre de tels effets. L’administration d’Akkermansia muciniphila a aussi été suffisante pour prévenir l’ensemble des altérations moléculaires normalement induites par la consommation d’agents émulsifiants, et notamment le rapprochement des bactéries de la paroi de l’épithélium.
« Ce travail conforte la notion que l’utilisation d’Akkermansia muciniphila en tant que probiotique pourrait être une approche pour maintenir la santé métabolique et intestinale contre les stress modernes tels que les agents émulsifiants qui promeuvent l’inflammation intestinale chronique, et les conséquences néfastes qui en résultent. De plus, cela suggère que la colonisation intestinale par Akkermansia muciniphila pourrait prédire la propension individuelle à développer des désordres intestinaux et métaboliques suivant la consommation d’émulsifiants : plus la présence de la bactérie est importante, plus l’individu serait protégé des effets néfastes des additifs alimentaires sur le microbiote », explique Benoît Chassaing, dernier auteur de l’étude.
2 Georgia State University, Center for inflammation, immunity and infection, Department of Biology
Gut, janvier 2023
DOI : 10.1136/gutjnl-2021-326835